Au delà d’un appareil de chauffage, une pompe à chaleur est également le siège de beaucoup de réactions physiques. Bien qu’il ne soit pas strictement nécessaire de les comprendre, il est très intéressant d’en saisir les bases.
a) Pourquoi le fluide se réchauffe et se refroidit ?
Lorsqu’il passe à travers l’échangeur, le fluide (plus froid que l’air), se charge naturellement en calories (par définition, la chaleur se déplace du corps le plus chaud vers le plus froid). Cependant, les pompes et les fluides sont optimisés pour que le fluide s’évapore dans… l’évaporateur. Pourquoi ? Car l’évaporation est endothermique. Cela signifie que lorsqu’un fluide s’évapore, il emmagasine de l’énergie, sans changer de température. Cette énergie, c’est la chaleur latente d’évaporation (exprimée en joules par kilogramme, J.kg-1). Cette énergie est ensuite restituée lors de la condensation, dans le condenseur. Au contraire, la condensation est exothermique (rejette de la chaleur). Le fait que la pompe à chaleur fonctionne sur un cycle de température correspondant aux températures d’évaporations et condensations du fluide, permet de transporter de l’énergie sans augmentation de température. Par conséquent, la différence de température nécessaire entre l’air et le fluide est réduite ; une pompe à chaleur peut donc fonctionner avec des températures extérieures relativement basses.
b) Le rendement
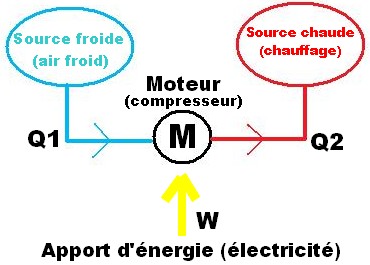
Le rendement d’une pompe à chaleur est défini par son COP. Finalement, c’est le rapport entre l’énergie absorbée par le compresseur, et l’énergie restituée sous forme de chauffage. Soient Q1, Q2, et W les quantités d’énergie mises en jeu.
Q1 ou Qfroid : Énergie « quittant » l’air extérieur
Q2 ou Qchaud : Énergie transmise à l’eau/air de chauffage
W : Énergie électrique fournie au compresseur
Soit n le rendement, défini par la formule :
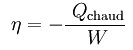 Avec Qchaud <0, et W>0
Avec Qchaud <0, et W>0
c) Diagramme de Clapeyron
Voici le cycle d’un fluide frigorigène dans un diagramme de Clapeyron.
d) Équation des gaz parfaits
Il existe une relation, qui s’applique aux gaz parfaits. Un gaz parfait est un modèle thermodynamique qui permet de décrire théoriquement le comportement des gaz, lorsque l’on fait varier leurs pression, température, et volume. On a ainsi l’équation des gaz parfaits :
PV = nRT
P : pression absolue (en Pascal, Pa)
V : volume (en mètre cube, m3)
n : quantité de gaz mise en jeu (en mole, mol)
R : constante des gaz parfaits (sans unité)R = 8,314 472 J.K-1.mol-1
T : température absolue (en Kelvin, K, avec x °C = x – 273,15 K )
Cette relation permet -entre autre- de s’apercevoir que pour une quantité de gaz donnée (comme par exemple dans un circuit de pompe à chaleur), pression, volume, et température sont directement liés (nR devient constant).



